ИЗУЧЕНИЕ АНТИОКСИДАНТНОЙ АКТИВНОСТИ АПОРФИНОВОГО АЛКАЛОИДА ГЛАУЦИНА И ПОЛУЧЕННОГО В СУБКРИТИЧЕСКОЙ ВОДЕ ФЕНАНТРЕНОВОГО АЛКАЛОИДА ДЕС-ГЛАУЦИНА
Аннотация
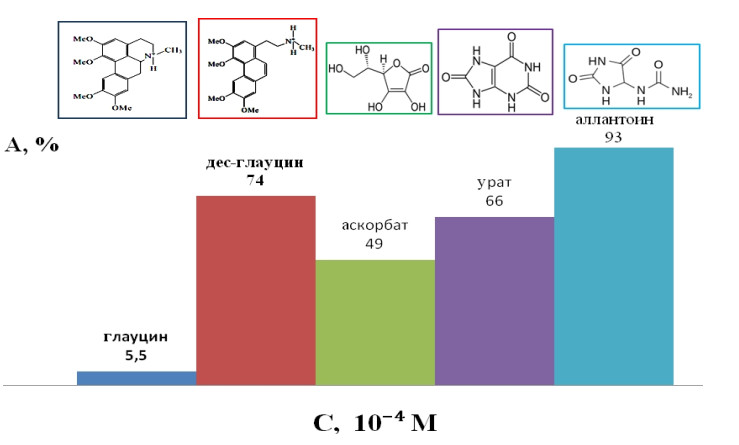
Антиоксидантную активность апорфинового алкалоида глауцина – 1,2,9,10-тетраметокси-6-α-апорфин (ГЛ), выделяемого из мачка желтого Glaucinumflavum, и фенантренового алкалоида дес-глауцина – 1-[2-(N-метиламиноэтил)]-3,4,6,7-тетраметоксифенантрен (д-ГЛ), синтезированного в среде субкритической воды, изучали invivo биолюминесцентным методом и в антирадикальной реакции с ДФПГ.
In vivo антиоксидантную активность алкалоидов оценивали по снижению индукции биолюминесценции штамма E. coli MG1655 (pKatG-lux), вызванной обработкой бактерий Н2О2. При добавлении в тест систему как ГЛ, так и д-ГЛ регистрировали уменьшение фактора индукции биолюминесценции, что указывает на снижении токсического действия Н2О2 на бактериальные клетки за счет антиоксидантной активности алкалоидов. Показатели антиоксидантной активности, определенные в биолюминесцентном тесте, в случае д-ГЛ были значительно выше, чем для изомера – ГЛ. Так, при концентрации д-ГЛ 0,2 мМ величина протекторной активности составила 86%, в то время как для ГЛ при этой же концентрации в 9,5 раз ниже – 9,3 %.
Поведение ГЛ и его фенантренового алкалоида д-ГЛ также сильно различается в реакции с ДФПГ. Дес-глауцин реагирует с ДФПГ намного быстрее и приводит к существенным изменениями в спектре поглощения ДФПГ. Величины EC50, полученные в тесте с ДФПГ, для д-ГЛ составила 0,3 мМ, тогда как для ГЛ EC50=5,3 мМ.
Таким образом, показано, что трансформация модельного алкалоида глауцина в его изомер с использованием среды субкритической воды позволяет получить фенантреновый алкалоид дес-глауцин, антиоксидантная активность которого многократно превышают активность исходного природного глауцина.
Скачивания
Metrics
Литература
Турмухамбетов А.Ж., Мукушева Г.К., Сейдахметова Р.Б., Шульц Э.Э., Шакиров М.М., Багрянская И.Ю., Га-тилов Ю.В., Адекенов С.М. Синтез и антимикробная активность четвертичных солей алкалоида глауцина // Хи-мико-фармацевтический журнал. 2009. Т. 43. № 5. С. 24–27.
Borisenko S.N., Bicherov A.V., Pavlyuk O.V., Rudnev M.I., Borisenko N.I., Vetrova E.V., Minkin V.I., Boris-enko R.N., Lekar A.V. Development of a method for des-glaucine production in a subcritical water medium // Russian Journal of Physical Chemistry B. 2009. Vol. 3. N8. Pp. 1131–1133.
O’Brien P., Carrasco-Pozo C., Speisky H. Boldine and its antioxidant or health-promoting properties // Chemico-Biological Interactions. 2006. Vol. 159. Pp. 1–17.
Spasova M., Philipov S., Milkova T. Amino acid derivatives of aporphinic alkaloid glaucine and their antioxidant activi-ty // Advances in experimental medicine and biology. 2009. Vol. 611. Pp. 267–268.
Ames B.N., Shigenaga M.K., Hagen T.M. Oxidants, antioxidants, and the degenerative diseases of aging // Proc. Natl. Acad. Sci. USA. 1993. Vol. 90. Pp. 7915–7922.
Antioxidants in Disease Mechanisms and Therapy, ed. Sies H. San Diego: Academic Press, 1996. 707 р.
Wright J.S., Johnson E.R., DiLabio G.A. Predicting the Activity of Phenolic Antioxidants: Theoretical Method, Analy-sis of Substituent Effects, and Application to Major Families of Antioxidants // J. Am. Chem. Soc. 2001. Vol. 123. Pp. 1173–1183.
Bauerova K., Bezek S. Role of Reactive Oxygen and Nitrogen Species in Etiopathogenesis of Rheumatoid Arthritis // Gen. Physiol. Biophys. 1999. Vol. 18. Focus Issue. Pp. 15–20.
Bauer V., Bauer F. Reactive Oxygen Species as Mediators of Tissue Protection and Injury // Gen. Physiol. Biophys. 1999. Vol. 18. Focus Issue. Pp. 7–14.
Perron N.R., Brumaghim J.L. A Review of the Antioxidant Mechanisms of Polyphenol Compounds Related to Iron Binding // Cell Biochem. Biophys. 2009. Vol. 53. Pp. 75–100.
Федина П.А., Яшин А.Я., Черноусова Н.И. Определение антиоксидантов в продуктах растительного происхож-дения амперометрическим методом // Химия растительного сырья. 2010. №2. С. 91–97.
Федосеева А.А., Лебедкова О.С., Каниболоцкая Л.В., Шендрик А.Н. Антиоксидантная активность настоев чая // Химия растительного сырья. 2008. №3. С. 123–127.
Кузьмин С.М., Чуловская С.А., Тесакова М.В., Семейкин А.С., Парфенюк В.И. Замещенные тетрафенилпор-фирины как перспективные молекулярные системы с высокой антиоксидантной активностью // Макрогетеро-циклы. 2014. Т. 7. №3. С. 218–224.
Zavilgelsky G.B., KotovaV.Yu., Manukhov I.V. Action of 1,1-dimethylhydrazine on bacterial cells is determined by hydrogen peroxide // Mutation Research. 2007. Vol. 634. Pp. 172–176.
Чистяков В.А., Празднова Е.В., Гутникова Л.В., Сазыкина М.А., Сазыкин И.С. Супероксидустраняющая ак-тивность производного пластохинона 10-(6'-пластохинонил) децил-трифенилфосфония (SkQ1) // Биохимия. 2012. T. 77. №7. С. 932–935.
Karadag A., Ozcelik B., Saner S. Review of Methods to Determine Antioxidant Capacities // Food Anal. Methods. 2009. Vol. 2. Pp. 41–60.
Чистяков В.А. Биохимические механизмы неспецифической защиты клетки от окислительного стресса : авто-реф. дис. … д-ра биол. наук. Ростов-на-Дону, 2011. 44 с.

This work is licensed under a Creative Commons Attribution 4.0 International License.
Авторы, которые публикуются в данном журнале, соглашаются со следующими условиями:
1. Авторы сохраняют за собой авторские права на работу и передают журналу право первой публикации вместе с работой, одновременно лицензируя ее на условиях Creative Commons Attribution License, которая позволяет другим распространять данную работу с обязательным указанием авторства данной работы и ссылкой на оригинальную публикацию в этом журнале.
2. Авторы сохраняют право заключать отдельные, дополнительные контрактные соглашения на неэксклюзивное распространение версии работы, опубликованной этим журналом (например, разместить ее в университетском хранилище или опубликовать ее в книге), со ссылкой на оригинальную публикацию в этом журнале.
3. Авторам разрешается размещать их работу в сети Интернет (например, в университетском хранилище или на их персональном веб-сайте) до и во время процесса рассмотрения ее данным журналом, так как это может привести к продуктивному обсуждению, а также к большему количеству ссылок на данную опубликованную работу.











