ГИСТОХИМИЧЕСКОЕ ИЗУЧЕНИЕ КЛЕТОК КСИЛЕМЫ У IRIS SIBIRICA L. В КУЛЬТУРЕ IN VITRO
Аннотация
В работе представлены данные содержания лигнина у однолетних растений-регенерантов Iris sibirica , сопоставимые с содержанием у шестилетних интактных растений. С целью выявления условий ускоренной лигнификации изучено строение побегов Iris sibirica , выросших на искусственных питательных средах, с использованием методов гистохимии.
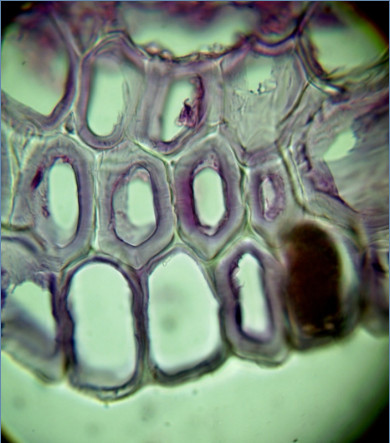
Отмечены особенности образования ксилемы у Iris sibirica на искусственных питательных средах. Очень быстро у регенерантов развивалась сложная система, состоящая из проводящих пучков, содержащих ситовидные трубки, сосуды и трахеиды, а также сети гидроцитов. Гидроциты Iris sibirica по своему строению – это трахеиды с лигнифицированными утолщениям, но, в отличие от трахеид и сосудов ксилемы (они образуются на базе прокамбия или камбия – особых латеральных первичной или вторичной меристем), гидроциты дифференцировались из клеток постоянных тканей (подобно феллогену), которые, вероятно, на момент дифференциации обладали меристематической активностью. У Iris sibirica гидроциты мощным слоем окутывали проводящий пучок и сопровождали его вдоль побега на некоторую высоту. Вследствие образования плотной ткани из лигнифицированных трахеальных элементов у молодых регенерантов Iris sibirica определялось высокое содержание лигнина.
Изучение дифференциации элементов ксилемы в лабораторных условиях может служить образцом для нашего понимания процессов формирования древесины.
Скачивания
Metrics
Литература
Turner J.A., Buongiorno J., Maplesden F., Zhu S., Bates S., Li R. World Wood Industries Outlook // Forest Research Bulletin. 2006. Vol. 230. Pp. 2005–2030. I
Turner S., Gallois P., Brown D. Tracheary Element Differentiation // Annu. Rev. Plant Biol. 2007. Vol. 58. Pp. 407–433.
Fukuda H. Plant tracheary elements // Encyclopedia of Life Sciences. 2010. Pp. 1–5.
Bollhöner B., Prestele J., Tuominen H. Xylem cell death: emerging understanding of regulation and function // Journal of Experimental Botany. 2012. Vol. 63. N3. Pp. 1081–1094.
Oda Y., Fukuda H. Secondary cell wall patterning during xylem differentiation // Current Opinion in Plant Biology. 2012. Vol. 15. N1. Pp. 38–44.
Антонова Г.Ф., Железниченко Т.В., Стасова В.В. Лигнификация каллуса сосны обыкновенной как реакция на условия культивирования и состав питательной среды // Cибирский лесной журнал. 2014. №6. С. 46–59.
Preeti Dahiya. Role of death in providing lifeline to plants // Trends in Plant Science. 2003. Vol. 8. Pp. 462–465.
Pesquet E., Ranocha P., Legay S., Digonnet C., Barbier O., Pichon M., Goffner D. Novel Markers of Xylogenesis in Zinnia Are Differentially Regulated by Auxin and Cytokinin1,[W] // Plant physiol. 2005. Vol. 139. Pp.1821–1839.
Oda Y., Hasezawa S. Review Cytoskeletal organization during xylem cell differentiation // Plant Tissue Cult. 2006. Vol. 119. N3. Pp. 167–177.
Pyo H., Demura T., Fukuda H. Tere; a novel cis-element responsible for a coordinated expression of genes related to programmed cell death and secondary wall formation during differentiation of tracheary elements // Plant J. 2007. Vol. 51. N6. Pp. 955–965.
Ibañes M., Fàbregas N., Chory J., Caño-Delgado A.I. Brassinosteroid signaling and auxin transport are required to es-tablish the periodic pattern of Arabidopsis shoot vascular bundles // Proc Natl Acad Sci USA. 2009. Vol. 106. N32. Pp. 13630–13635.
Kwon S.I., Cho H.J., Park O.K. Role of Arabidopsis RabG3b and autophagy in tracheary element differentiation // Au-tophagy. 2010. Vol. 6. N8. Pp. 1187–1189
Kwon S.I., Cho H.J., Jung J.H., Yoshimoto K., Shirasu K., Park O.K. The Rab GTPase RabG3b functions in autophagy and contributes to tracheary element differentiation in Arabidopsis. // Plant J. 2010. Vol. 64. N1. Pp. 151–164.
Fàbregas N., Ibañes M., Caño-Delgado A.I. A systems biology approach to dissect the contribution of brassinosteroid and auxin hormones to vascular patterning in the shoot of Arabidopsis thaliana // Plant Signal Behav. 2010. Vol. 5. N7. Pp. 903–906.
Milioni D., Sado P.E., Stacey N.J., Roberts K., McCann M.C. Early gene expression associated with the commitment and differentiation of a plant tracheary element is revealed by cDNA-amplified fragment length polymorphism analysis // Plant Cell. 2002. Vol. 14. N11. Pp. 2813–2824.
Demura T., Tashiro G., Horiguchi G., Kishimoto N., Kubo M., Matsuoka N., Minami A., Nagata-Hiwatashi M., Nakamura K., Okamura Y., Sassa M., Suzuki S., Yazaki J., Kikuchi S., Fukuda H. Visualization by comprehensive microarray analysis of gene expression programs during transdifferentiation of mesophyll cells into xylem cells // Proceedings of the National Academy of Sciences of the United States of America, 2002. Vol. 99. N24. Pp. 15794–15799.
Möller R., Koch G., Nanayakkara B., Schmitt U. Lignification in cell cultures of Pinus radiata: activities of enzymes and lignin topochemistry // Tree Physiology. 2005. Vol. 26. N2. Pp. 201–210.
Kubo M., Udagawa M., Nishikubo N., Horiguchi G., Yamaguchi M., Ito J., Mimura T., Fukuda H., Demura T. Transcription switches for protoxylem and me taxylem vessel formation // Genes Dev. 2005. Vol. 19. Pp. 1855–1860.
Devillard C., Walter C. Formation of plant tracheary elements in vitro – a review // New Zealand Journal of Forestry Science. 2014. Vol. 44. Pp. 2–14.
Fukuda H. Xylogenesis: initiation, progression, and cell death // Annual Review of Plant Physiology and Plant Molecular Biology. 1996. Vol. 47. N1. Pp. 299–325.
McCann M.C. Tracheary element formation: Building up to a dead end // Trends in Plant Science. 1997. Vol. 2. N9. Pp. 333–338.
Denton D., Nicolson S., Kumar S. Cell death by autophagy: facts and apparent artefacts // Cell Death and Differentiation. 2012. Vol. 19. N1. Pp. 87–95.
Kuriyama H., Fukuda H. Developmental programmed cell death in plants // Current Opinion in Plant Biology. 2002. Vol. 5. N6. Pp. 568–573.
McCabe P.F., Leaver C.J. Programmed cell death in cell cultures // Plant Molecular Biology. 2000. Vol. 44. N3. Pp. 359–368.
Fukuda, H. Signals that control plant vascular cell differentiation // Nature Reviews Molecular Cell Biology. 2004. Vol. 5. N5. Pp. 379–391.
Kohlenbach H.W., Schöpke C. Cytodifferentiation to tracheary elements from isolated mesophyll protoplasts of Zinnia elegans // Naturwissenschaften. 1981. Vol. 68. Pp. 576–577.
Roberts A.V., Walker S., Horan I., Smith E.F., Mottley J. The effect of growth retardants, humidity and lighting at Stage III on Stage IV of micropropagation inchrysanthemum and rose // Acta Hortic. 1992. Vol. 319. Рp. 153–158.
Lacayo C.I., Malkin A.J., Holman H.Y.N., Chen L., Ding S.Y., Hwang M.S., Thelen M.P. Imaging cell wall architecture in single Zinnia elegans tracheary elements // Plant Physiology. 2010. Vol. 154. N1. Pp. 121–133.
Höfte H. Plant cell biology: how to pattern a wall // Current Biology. 2010. Vol. 20. N1. Pp. 450–452.
Базарнова Н.Г., Ильичёва Т.Н., Тихомирова Л.И., Синицына А.А. Скрининг химического состава и биологиче-ской активности Iris sibirica L. сорт Cambridge // Химия растительного сырья. 2016. №3. С. 49–57.
Тихомирова Л.И., Ильичёва Т.Н., Базарнова Н.Г., Сысоева А.В. Способ получения лекарственного раститель-ного сырья лапчатки белой (Potentilla alba L.) в условиях гидропоники // Химия растительного сырья. 2016. №3. C. 59–66.
Базарнова Н.Г., Тихомирова Л.И., Фролова Н.С., Микушина И.В. Выделение и анализ экстрактивных веществ лапчатки белой (Potentilla alba L.), выращенной в различных условиях // Химия растительного сырья. 2016. №1. С. 43–51.
Оболенская А.В. Лабораторные работы по химии древесины и целлюлозы: учебное пособие. М., 1991. 320 с.
Музычкина Р.А., Корулькин Д.Ю., Абилов Ж.А. Технология производства и анализ фитопрепаратов. Алматы, 2011. 360 с.
Калинин Ф.Л., Сарнацкая В.В., Полищук В.Е. Методы культуры в физиологии и биохимии растений. Киев, 1980. 488 с.
Murashige T., Skoog F. A Revised Medium for Rapid Growth and Bioassaya with Tobacco Tissue cultures // Physiol. Plant. 1962. Vol. 15. N4. Рp. 473.
Барыкина Р.П., Веселова Т.Д., Девятов А.Г. Справочник по ботанической микротехнике. Основы и методы. М., 2004. 312 с.
Дженсен У. Ботаническая гистохимия. М., 1965. 377 с.
Клеточная оболочка растительной клетки. [Электронный ресурс]. URL: http://www.activestudy.info/kletochnaya- obolochka-rastitelnoj-kletki/.
Шанидзе М.А. Анатомический анализ вегетативных органов грузинских представителей рода Iris как материал для познания филогенеза рода : автореф. дис. … канд. биол. наук. Тбилиси, 1955. 25 с.
Эсау К. Анатомия растений. М., 1969. 564 с.
Чурикова О.А. Некоторые закономерности морфогенеза in vitro // Биотехнология как инструмент сохранения биоразнообразия растительного мира. Сборник статей по материалам II Всероссийской научно-практической конференции. Волгоград, 2008. С. 276–282.
Раздорский В.Ф. Архитектоника растений. М., 1955. 402 с.
Александров В.Г. Анатомия растений. М., 1966. 431 с.
Roberts L.W. The initiation of xylem differentiation // Bot. Rev. 1969. Vol. 35. N3. Pp. 201–250.
Wagner A., Donaldson L., Ralph J. Lignification and Lignin Manipulations in Conifers // Advances in Botanical Research. 2012. Vol. 61. Pp. 37–76.
Roberts K., McCann M.C. Xylogenesis: The birth of a corpse // Current Opinion in Plant Biology. 2000. Vol. 3. N6. Pp. 517–522.

This work is licensed under a Creative Commons Attribution 4.0 International License.
Авторы, которые публикуются в данном журнале, соглашаются со следующими условиями:
1. Авторы сохраняют за собой авторские права на работу и передают журналу право первой публикации вместе с работой, одновременно лицензируя ее на условиях Creative Commons Attribution License, которая позволяет другим распространять данную работу с обязательным указанием авторства данной работы и ссылкой на оригинальную публикацию в этом журнале.
2. Авторы сохраняют право заключать отдельные, дополнительные контрактные соглашения на неэксклюзивное распространение версии работы, опубликованной этим журналом (например, разместить ее в университетском хранилище или опубликовать ее в книге), со ссылкой на оригинальную публикацию в этом журнале.
3. Авторам разрешается размещать их работу в сети Интернет (например, в университетском хранилище или на их персональном веб-сайте) до и во время процесса рассмотрения ее данным журналом, так как это может привести к продуктивному обсуждению, а также к большему количеству ссылок на данную опубликованную работу.











