ВЛИЯНИЯ ТЕМПЕРАТУРНЫХ УСЛОВИЙ НА НАКОПЛЕНИЕ ПЕРВИЧНЫХ И ВТОРИЧНЫХ МЕТАБОЛИТОВ ЛИШАЙНИКАМИ FLAVOCETRARIA CUCULLATA И CETRARIA LAEVIGATA
УДК 577.121:582.29
Аннотация
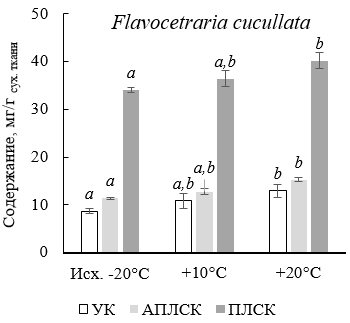
Проведено исследование влияния температуры в камеральных условиях на накопление первичных и вторичных метаболитов лишайниками Flavocetraria cucullata (Bellardi) Kärnefelt & Thell и Cetraria laevigata Rass. Образцы лишайников извлекали из-под снега (-20 °С) вместе с почвенным субстратом и переносили в климатическую камеру. После чего последовательно повышали температуру в климатической камере до +10 и +20 °С. Экспозиция лишайников проводилась в течение 30 дней для каждого температурного режима. Анализ первичных метаболитов проводили методом газовой хромато-масс-спектрометрии. Показано, что у лишайников F. cucullata и C. laevigata при температурах +10 и +20 °С наблюдалось повышение содержания маннитола, рибитола, сахарозы и гидроксипролина, а также снижение содержания ненасыщенных жирных кислот по сравнению с исходными образцами. В то же время содержание глицерина и арабитола в талломах исходных лишайников (-20 °С) было выше, чем после экспозиции при +10 и +20 °С, что, по-видимому, связно с криопротекторными свойствами данных соединений. Содержание вторичных метаболитов в лишайниках определяли методом высокоэффективной жидкостной хроматографии. Показано, что содержание усниновой, алло-протолихестериновой и протолихестериновой кислот в лишайниках F. cucullata после экспозиции в климатической камере возрастало, что может быть связано с общей активацией метаболических процессов при повышении температуры. В то же время содержание фумарпротоцетраровой кислоты в лишайниках C. laevigata снижалось при температурах +10 и +20 °С по сравнению с исходными образцами, что может быть связано с ее защитными свойствами при действии низкотемпературного стресса.
Скачивания
Metrics
Литература
Poryadina L.N., Prokop'yev I.A., Konoreva L.A., Chesnokov S.V., Sleptsov I.V., Filippova G.V., Shashurin M.M. Prirodnyye resursy Arktiki i Subarktiki, 2018, no. 4 (26), pp. 109–117. DOI: 10.31242/2618-9712-2018-26-4-109-117. (in Russ.).
Harańczyk H., Casanova-Katny A., Olech M., Strzałka K. Plant Adaptation Strategies in Changing Environment. Sin-gapore, 2017, pp. 77–102. DOI: 10.1007/978-981-10-6744-0_3.
Bhattacharya S. Cryopreservation Biotechnology in Biomedical and Biological Sciences. IntechOpen, 2018, pp. 8–19. DOI: 10.5772/intechopen.80477.
Selivanova Ye.A. Byulleten' Orenburgskogo nauchnogo tsentra UrO RAN, 2012, no. 3, pp. 1–11. (in Russ.).
Prokop'yev I.A., Sleptsov I.V., Poryadina L.N., Rozhina S.M. Khimiya rastitel'nogo syr'ya, 2020, no. 4, pp. 211–217. DOI: 10.14258/jcprm.2020047443. (in Russ.).
Prokop'yev I.A., Sleptsov I.V., Poryadina L.N., Rozhina S.M. Prirodnyye resursy Arktiki i Subarktiki, 2020, vol. 25, no. 1, pp. 94–100. (in Russ.).
Shen B., Hohmann S., Jensen R.G., Bohnert H.J. Plant Physiol., 1999, vol. 121(1), pp. 45–52. DOI: 10.1104/pp.121.1.45.
Baruch E., Belostotskii A.M., Mastai Y. Journal of Molecular Structure, 2008, vol. 874, pp. 170–177. DOI: 10.1016/j.molstruc.2007.03.054.
Tibbett M., Sanders F.E., Cairney J.W.G. Mycorrhiza, 2002, vol. 12, pp. 249–255. DOI: 10.1007/s00572-002-0183-8.
Los' D.A. Vestnik RAN, 2005, vol. 75, no. 4, pp. 338–345. (in Russ.).
Niu Y., Xiang Y. Front. Plant Sci., 2018, vol. 9, 915. DOI: 10.3389/fpls.2018.00915.
Tan L., Zhuo R., Li S., Ma F., Zhang X. J. Sci. Food Agric., 2017, vol. 97, pp. 1876–1884. DOI: 10.1002/jsfa.7990.
Chalker-Scott L. Photochemistry and Photobiology, 1999, vol. 70, no. 1, pp. 1–9. DOI: 10.1111/j.1751-1097.1999.tb01944.x.
Hoshino T., Odaira M., Yoshida M., Tsuda S. Journal of Plant Research, 1999, vol. 112, pp. 255–261. DOI: 10.1007/PL00013875.
Prokopev I.A., Filippova G.V. Chemistry of Natural Compounds, 2019, vol. 55(5), pp. 945–947. DOI: 10.1007/s10600-019-02855-9.
Kosanić M., Ranković B., Stanojković T., Rančić A., Manojlović N. LWT Food Sci. Technol., 2014, vol. 59, pp. 518–525. DOI: 10.1016/j.lwt.2014.04.047.
Wingsle G., Karpinski S., Hallgren J.-E. Phyton, 1999, vol. 4, pp. 253–268.
Rice-Evans C.A., Miller N.J., Paganga G. Trends in Plant Science, 1997, vol. 2, pp. 152–159. DOI: 10.1016/S1360-1385(97)01018-2.
Brisdelli F., Perilli M., Sellitri D., Piovano M., Garbarino J.A., Nicoletti M., Bozzi A., Amicosante G., Celenza G. Phytotherapy Research, 2013, vol. 27(3), pp. 431–437. DOI: 10.1002/ptr.4739.
Sisodia R., Geol M., Verma S., Rani A., Dureja P. Nat. Prod. Res., 2013, vol. 27, pp. 2235–2239. DOI: 10.1080/14786419.2013.811410.
Copyright (c) 2021 Химия растительного сырья

Это произведение доступно по лицензии Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.

This work is licensed under a Creative Commons Attribution 4.0 International License.
Авторы, которые публикуются в данном журнале, соглашаются со следующими условиями:
1. Авторы сохраняют за собой авторские права на работу и передают журналу право первой публикации вместе с работой, одновременно лицензируя ее на условиях Creative Commons Attribution License, которая позволяет другим распространять данную работу с обязательным указанием авторства данной работы и ссылкой на оригинальную публикацию в этом журнале.
2. Авторы сохраняют право заключать отдельные, дополнительные контрактные соглашения на неэксклюзивное распространение версии работы, опубликованной этим журналом (например, разместить ее в университетском хранилище или опубликовать ее в книге), со ссылкой на оригинальную публикацию в этом журнале.
3. Авторам разрешается размещать их работу в сети Интернет (например, в университетском хранилище или на их персональном веб-сайте) до и во время процесса рассмотрения ее данным журналом, так как это может привести к продуктивному обсуждению, а также к большему количеству ссылок на данную опубликованную работу.











