СРАВНИТЕЛЬНОЕ ИССЛЕДОВАНИЕ ЭЛЕМЕНТНОГО СОСТАВА И БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ РАСТЕНИЙ РОДА SAUSSUREA DC. ФЛОРЫ ВОСТОЧНОЙ СИБИРИ
Аннотация
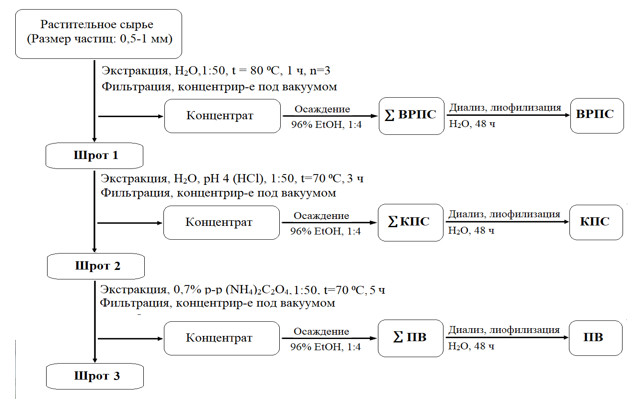
Методом масс-спектрометрии c индуктивно-связанной плазмой определено содержание эссенциальных, условно-эссенциальных и токсичных элементов в 7 растениях рода Saussurea (соссюрея): с. мелкоцветковой (S. parviflora (Poir.) DC.), с. широколистной (S. latifolia Ledeb.), с. горькой (S. amara (L.) DC.), с. Фролова (S. frolowii Ledeb.), с. даурской (S. daurica Adams.), с. иволистной (S. salicifolia (L.) DC.) и с. спорной (S. contrоversa DC.). Впервые выявлены представители рода Saussurea, накапливающие значительное количество кальция – S. salicifolia, S. controversa, S. frolowii (42357, 41376 и 23818 мг/кг соответственно), коррелирующего с содержанием водорастворимых полисахаридов. Преобладающее количество магния определено в S. daurica, S. contrоversa и S. amara (7183, 2826 и 1927 мг/кг), фосфора – в S. frolowii, S. controversa и S. parviflora (1740, 1378 и 1117 мг/кг), ванадия – в S. salicifolia и S. controversa (1.2 и 1.1 мг/кг). Селен в количестве 0.8 мг/кг обнаружен в S. daurica. Установлено количественное содержание основных фракций полисахаридных комплексов, флавоноидов, гидроксикоричных кислот данных видов. Наибольшее содержание флавоноидов и гидроксикоричных кислот установлено в надземных органах S. controversa, S. latifolia, и S. daurica. Вид S. controversa, содержащий максимальные количества фракций водорастворимых полисахаридов, фенольных соединений и биоэлементов, является перспективным объектом для дальнейших фармацевтических исследований.
Скачивания
Metrics
Литература
Микулич Е.В. Современные принципы лечения хронического остеомиелита // Вестник новых медицинских технологий. 2012. № 2, С.180–184.
Новомлинский В.В., Малкина Н.А., Андреев А.А., Глухов А.А., Микулич Е.В.Современные аспекты диагностики и лечения остеомиелита. Обзор литературы // Современные проблемы науки и образования. 2016. № 5, C.122.
Shou D., Zhang Y., Shen L., Zheng R., Huang X., Mao Z., Yu Z., Wang N., Zhu Y. Flavonoids of herba epimedii enhances bone repair in a rabbit model of chronic osteomyelitis during post-infection treatment and stimulates osteoblast proliferation in vitro // Phytotherapy research. 2017. Vol.5. no.31, pp. 330 – 339. DOI: 10.1002/ptr.5755.
Zhang Y., Yan M., Yu Q.F., Yang P.F. Zhang H.D, Sun Y.H, Zhang Z.F, Gao Y.F. Puerarin prevents LPS-Induced osteoclast formation and bone loss via inhibition of akt activation // Biol. pharm. bull. 2016. no. 39 (12), pp. 2028 – 2035. DOI: 10.1248/bpb.b16-00522.
Jeong Y.T., Baek S.H., Jeong S.C., Yoon Y.D., Kim O.H., Oh B.C., Jung J.W., Kim J.H.
Osteoprotective effects of polysaccharide-enriched Hizikia fusiforme processing by product in vitro and in vivo models // Journal of medicine food. 2016. Vol.19. no. 8, pp. 805 – 814. DOI: 10.1089/jmf.2015.3646.
Niu W., Wang Y., Liu Y., Zhang B., Liu M., Luo Y., Zhao P., Zhang Y., Wu H., Ma L., Li Z. Starch-derived absorbable polysaccharide hemostat enhances bone healing via BMP-2 protein // Acta histochem. 2017. no.119 (3), pp. 257 – 263. DOI: 10.1016/j.acthis.2017.01.011.
Du L., Nong N., Zhao J., Peng X., He J., Wu Y., Shi X., Zong S., Zeng G.F. Polygonatum sibiricum polysaccharide inhibits osteoporosis by promoting osteoblast formation and blocking osteoclastogenesis through Wnt/β-catenin signalling pathway // Scientific reports. 2016. no. 6, pp. 1–12. DOI: 10.1038/srep32261.
Folwarczna J., Pytlik M., Zych M., Cegiela U., Nowinska B., Kaczmarczyk-Sedlak I., Sliwinski L., Trzeciak H., Trzeciak H.I. Effects of caffeic and chlorogenic acids on the rat skeletal system // European review for medical and pharmacological sciences. 2015. no.19, pp. 682 – 693.
Kuroyanagi G., Tokuda H., Yamamoto N., Kainuma S., Fujita K., Ohguchi R., Kawabata T., Sakai G., Matsushima-Nishiwaki R., Harada A., Kozawa O., Otsuka T. (-)-Epigallocatechin gallate synergistically potentiates prostaglandin E2-stimulated osteoprotegerin synthesis in osteoblasts // Prostaglandins other lipid mediat. 2017. Vol.129, pp. 27 – 33. DOI: 10.1016/j.prostaglandins.2017.02.001.
Takeda E., Yamamoto H., Yamanaka-Okumura H., Taketani Y. Dietary phosphorus in bone health and quality of life // Nutrition reviews. 2012. Vol.70. no. 6, pp. 311 – 321. DOI: 10.1111/j.1753-4887.2012.00473.x.
Makgoba M.W., Datta H.K. The critical role of magnesium ions in osteoclast- matrix interaction: implications for divalent cations in the study of osteoclastic adhesion molecules and bone resorption // European journal of clinical investigation. 1992. no. 22, pp. 692-696.
Belluci M.M., Giro G., del Barrio R.A.L., Pereira R.M.R., Marcantonio E. Jr., Orrico S.R.P. Effects of magnesium intake deficiency on bone metabolism and bone tissue around osseointegrated implants // Clinical oral implants research. 2011. no. 22, pp. 716 – 721. DOI: 10.1111/j.1600-0501.2010.02046.x.
Hunt C.D. Dietary Boron: An overview of the evidence for its role in immune function // The journal of trace elements in experimental medicine. 2003. no. 16, pp. 291–306.
Nielsen F.H., Stoecker B.J. Boron and fish oil have different beneficial effects on strength and trabecular microarchitecture of bone // Journal of trace elements in medicine and biology. 2009. no. 23. pp. 195 – 203. DOI: 10.1016/j.jtemb.2009.03.003.
Ying X., Cheng S., Wang W., Lin Z., Chen Q., Zhang W., Kou D., Shen Y., Cheng X., Rompis F.A., Peng L., Lu C. Effect of boron on osteogenic differentiation of human bone marrow stromal cells // Biol. trace elem. res. 2011. no. 144, pp. 306 – 315. DOI: 10.1007/s12011-011-9094-x.
Barrio D.A., Etcheverry S.B. Vanadium and bone development: putative signaling pathways // Can. J. physiol. pharmacol. 2006. no. 84, pp. 677 – 686. DOI: 10.1139/y06-022.
Yamaguchi M., Oishi H., Suketa Y. Effect of vanadium on bone metabolism in weanling rats: zinc prevents the toxic effect of vanadium // Research in experimental medicine. 1989. no. 189, pp. 47 – 53.
Scibior A., Adamczyk A., Mroczka R., Niedzwiecka I., Gołębiowska D., Fornal E. Effects of vanadium (V) and magnesium (Mg) on rat bone tissue: mineral status and micromorphology. Consequences of V–Mg interactions // Metallomics. 2014. no. 6, pp. 2260 – 2278. DOI: 10.1039/c4mt00234b.
Grazul M., Budzisz E. Biological activity of metal ions complexes of chromones, coumarins and flavones // Coordination chemistry reviews. 2009. Vol. 253. no. 21-22, pp.2588 – 2598. DOI: 10.1016/j.ccr.2009.06.015.
Kalinowska M. Spectroscopic, thermogravimetric and biological studies of Na(I), Ni(II) and Zn(II) complexes of quercetin // J. therm. anal. calorim. 2016. Vol.126, pp.141 – 148. DOI: 10.1007/s10973-016-5362-5.
Кабата-Пендиас А. Микроэлементы в почвах и растениях / А. Кабата-Пендиас, Х. Пендиас, – М.: Мир, 1989. 439 с.
Государственная фармакопея Российской Федерации XIII издания. В 3-х томах. Москва, 2015. 1003 с.
Липшиц С.Ю. Род Saussurea DC. (Аsteraceae) / С.Ю. Липшиц. – Ленинград: Наука, 1979. 283 c.
Shurupova M.N., Zverev A.A. Conservation categories and rarity types of Siberian Saussurea species // International journal of environmental studies. 2017. no.74(5), pp. 724 – 731. DOI: 10.1080/00207233.2017.1283937.
Погодин И.С., Лукша E.A., Предейн Н.A. Химический состав растений рода Saussurea DC., произрастающих на территории Сибири // Химия растительного сырья. 2014. №. 3, С. 43 – 52. DOI: 10.14258/jcprm.1403043.
Kang K., Lee H.J., Kim Ch.Y., Lee S.B., Tunsag J., Batsuren D., Nho Ch.W. The chemopreventive effects of Saussurea salicifolia through Induction of apoptosis and phase II detoxification enzyme // Pharm. society of Japan. 2007. Vol. 30. no. 12, pp. 2352–2359.
Yang Z. D., Gao K., Jia Z. J. Eudesmane derivates and other constituents from Saussurea parviflora // Phytochemistry. 2003. Vol. 62. no. 8 , pp. 1195 – 1199. DOI: 10.1016/S0031-9422(02)00758-6.
Xu M., Guo Q., Wang S., Wang N., Wei L., Wang J. Anti-rheumatoid arthritic effects of Saussurea involucrata on type II collagen-induced arthritis in rats // Food funct. 2016. no. 7, pp. 763 – 770. DOI: 10.1039/c5fo00603a.
Авдеева Е.Ю., Зоркальцев М.А., Завадовская В.Д., Слизовский Г.В., Краснов Е.А., Пехенько В.Г., Степанов М.Ю. Исследование активности экстрактов Saussurea controversa и Filipendula ulmaria при экспериментальном остеомиелите с помощью трехфазной сцинтиграфии // Бюлл. сибир. мед. 2015. Т. 14. № 3. С. 5 – 9. DOI: 10.20538/1682-0363-2015-3-5-9.
Перевозчикова Т.В., Авдеева Е.Ю., Файт Е.А., Скороходова М.Г., Краснов Е.А. Влияние экстрактов Saussurea controversa и Fillipendula ulmaria на иммунологическую реактивность крыс с экспериментальным остеомиелитом // Эксперим. и клинич. фармакология. 2016. Т. 79. № 6. С. 68 – 72. DOI: 10.30906/0869-2092-2016-79-7-16-20.
Avdeeva E., Reshetov Y., Shurupova M., Zibareva L., Borisova E., Belousov M. Chemical analysis of bioactive substances in seven siberian Saussurea species // AIP Conference Proceedings. 2017. Vol. 1899. pp. 050001-1– 050001-7. DOI:10.1063/1.5009864.
Ларькина М.С., Кадырова Т.В., Ермилова Е.В. Изучение динамики накопления фенолкарбоновых кислот в надземной части василька шероховатого // Химия растительного сырья. 2008. №. 3, С. 71–74.
Горина Я.В., Головченко В.В., Оводов Ю.С., Сапрыкина Э.В., Краснов Е.А. Выделение, характеристика и биологическая активность полисахаридов звездчатки средней Stellaria media L. // Вопросы биологической, медицинской и фармацевтической химии. 2012. № 2, С. 9–15.
Коломиец Н.Э., Полуэктова Т.В., Федько И.В., Абрамец Н.Ю., Смолякова И.М., Авдеенко С.Н. Растения как источники элементов, необходимых для здоровья костей и суставов // Фундаментальные исследования. 2014. № 8, С. 1635 –1639.
Баяндина И.И., Загурская Ю.В. Взаимосвязь вторичного метаболизма и химических элементов в лекарственных растениях // Сибирский медицинский журнал. 2014. №8, С.107–111.
ПНД Ф 16.2.2:2.3.71-2011. Количественный химический анализ почв. Методика измерения массовых долей металлов в осадках сточных вод, донных отложениях, образцах растительного происхождения спектральными методами. М., 2011. 38 с.
ПНД Ф 16.1:2.3:3.11-98. Количественный химический анализ почв. Методика выполнения измерений содержания металлов в твердых объектах методом спектрометрии с индуктивно-связанной плазмой. М., 1998. 31 с.
Beach R. S., Gershwin E. M. Hurley L. S. Zinc, Copper, and Manganese in immune function and experimental oncogenesis // Nutrition and cancer. 1982. pp.172 – 191.
Зубков Н.В., Зубкова В.М. Накопление сухой массы и распределение в растениях тяжелых металлов при различной концентрации их в почве // Вестник Московского городского педагогического университета. Серия: Естественные науки. 2010. № 2. С. 43 – 56.
Кайгородов Р.В. Устойчивость растений к химическому загрязнению: учеб. пособие // Перм. гос. ун-т. – Пермь, 2010.– 151 с.

This work is licensed under a Creative Commons Attribution 4.0 International License.
Авторы, которые публикуются в данном журнале, соглашаются со следующими условиями:
1. Авторы сохраняют за собой авторские права на работу и передают журналу право первой публикации вместе с работой, одновременно лицензируя ее на условиях Creative Commons Attribution License, которая позволяет другим распространять данную работу с обязательным указанием авторства данной работы и ссылкой на оригинальную публикацию в этом журнале.
2. Авторы сохраняют право заключать отдельные, дополнительные контрактные соглашения на неэксклюзивное распространение версии работы, опубликованной этим журналом (например, разместить ее в университетском хранилище или опубликовать ее в книге), со ссылкой на оригинальную публикацию в этом журнале.
3. Авторам разрешается размещать их работу в сети Интернет (например, в университетском хранилище или на их персональном веб-сайте) до и во время процесса рассмотрения ее данным журналом, так как это может привести к продуктивному обсуждению, а также к большему количеству ссылок на данную опубликованную работу.











