РАЗРАБОТКА ПОДХОДОВ К МОЛЕКУЛЯРНОМУ МОДЕЛИРОВАНИЮ ВЗАИМОДЕЙСТВИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ КОМПОНЕНТОВ ГУМИНОВЫХ ВЕЩЕСТВ С БЕТА-ЛАКТАМАЗАМИ НА ПРИМЕРЕ ГУМИНОПОДОБНЫХ НИЗКОМОЛЕКУЛЯРНЫХ АНАЛОГОВ
УДК 577(11+151+181)
Аннотация
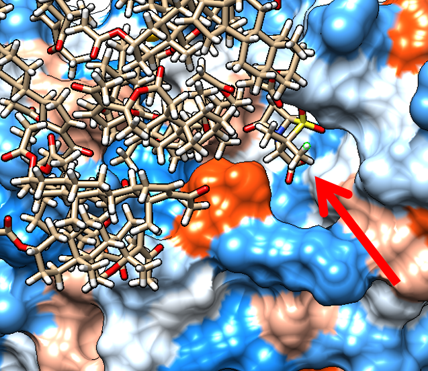
Для защиты беталактамных антибиотиков от действия резистентных бактерий используются ингибиторы β-лактамаз. Однако из-за появления устойчивости к β-лактамным ингибиторам поиск новых ингибиторов небеталактамной природы является актуальной задачей. В данной работе в качестве нового источника ингибиторов бета-лактамаз рассматриваются природные гуминовые вещества (ГВ). Ранее мы сообщали о способности гуминовых кислот угля и их узких фракций ингибировать β-лактамазы ТЕМ-1. Цель данной работы состояла в изучении механизма взаимодействия молекулярных компонентов гуминовых веществ с применением методов молекулярного моделирования. Отбор гуминоподобных молекул осуществляли с помощью метода дерепликации на основании известной ингибирующей активности фракции ГВ и ее молекулярного состава, найденного методом масс-спектрометрии высокого разрешения. Моделирование взаимодействия отобранных молекул с белком бета-лактамазы вели методами докинга и молекулярной динамики с использованием ПО Chimera v.1.15. и Amber14. В результате дерепликации было идентифицировано 156 уникальных структур, из которых отобраны три. Результаты моделирования показали, что наиболее вероятным механизмом взаимодействия ГВ с бета-лактамазой является неконкурентное ингибирование в результате связывания с аллостерическим сайтом белка. Кроме того, возможна неспецифическая агрегация на поверхности белка, которая так же объясняет синергетическое действия на сульбактам путем стерического блокирования его в активном сайте. Показана перспективность применения метода дерепликации для изучения молекулярных механизмов биологической активности гуминовых веществ.
Скачивания
Metrics
Литература
Hamad B. Nature reviews Drug discovery, 2010, vol. 9, no. 9, pp. 675. DOI: 10.1038/nrd3267.
WHO. New report calls for urgent action to avert antimicrobial resistance crisis. // World Health Organization website. https://www. who. int/news-room/detail/29-04-2019-new-report-calls-for-urgent-action to avert-antimicrobial-resistance-crisis. Accessed. 2023. DOI: 10.1007/s12668-019-00658-4.
Blair J.M., Webber M.A., Baylay A.J., Ogbolu D.O., Piddock L.J. Nature reviews microbiology, 2015, vol. 13, no. 1, pp. 42–51. DOI: 10.1038/nrmicro3380.
Hall B.G., Barlow M. Journal of Antimicrobial Chemotherapy, 2005, vol. 55, no. 6, pp. 1050–1051. DOI: 10.1093/jac/dki130.
Biondi S., Long S., Panunzio M., L. Qin W. Current medicinal chemistry, 2011, vol. 18, no. 27, pp. 4223–4236. DOI: 10.2174/092986711797189655.
Docquier J.D., Mangani S. Drug Resistance Updates, 2018, vol. 36, pp. 13–29. DOI: 10.1016/j.drup.2017.11.002.
Strynadka N.C., Jensen S.E., Alzari P.M., James M.N. Nature structural biology, 1996, vol. 3, no. 3, pp. 290–297. DOI: 10.1038/nsb0396-290.
Roccatano D., Sbardella G., Aschi M., Amicosante G., Bossa C., Nola A.D., Mazza F. Journal of computer-aided molecular design, 2005, vol. 19, pp. 329–340. DOI: 10.1007/s10822-005-7003-0.
Jelsch C., Mourey L., Masson J.M., Samama J.P. Proteins: Structure, Function, and Bioinformatics, 1993, vol. 16, no. 4, pp. 364–383. DOI: 10.1002/prot.340160406.
Livermore D.M. Journal of Antimicrobial Chemotherapy, 1993, vol. 31, pp. 9–21. DOI: 10.1093/jac/31.suppl_A.9.
Drawz S.M., Bonomo R.A. Clinical microbiology reviews, 2010, vol. 23, no. 1, pp. 160-201. DOI: 10.1128/cmr.00037-09.
Orlov A.A., Zherebker A., Eletskaya A.A., Chernikov V.S., Kozlovskaya L.I., Zhernov Y.V., Kostyukevich Y., Palyulin V.A., Nikolaev E.N., Osolodkin D.I., Perminova I.V. Scientific Reports, 2019, vol. 9, no. 1, pp. 12066. DOI: 10.1038/s41598-019-48000-y.
Piccolo A. Advances in Agronomy, 2002, pp. 57–134. DOI: 10.1016/S0065-2113(02)75003-7.
Kleinhempel D. Archives of Agronomy and Soil Science, 1970, vol. 14, no. 1, pp. 3–14. DOI: 10.1080/03650347009412655.
Mikhnevich T.A., Vyatkina A.V., Grigorenko V.G., Rubtsova M.Y., Rukhovich G.D., Letarova M.A., Kravtsova D.S., Vladimirov S.A., Orlov A.A., Nikolaev E.N., Zherebker A. ACS omega, 2021, vol. 6, no. 37, pp. 23873–23883. DOI: 10.1021/acsomega.1c02841.
Zhernov Y.V., Kremb S., Helfer M., Schindler M., Harir M., Mueller C., Hertkorn N., Avvakumova N.P., Konstantinov A.I., Brack-Werner R., Schmitt-Kopplin P. New Journal of Chemistry, 2017, vol. 41, no. 1, pp. 212–224. DOI: 10.1039/C6NJ00960C.
Zhernov Y.V., Konstantinov A.I., Zherebker A., Nikolaev E., Orlov A., Savinykh M.I., Kornilaeva G.V., Karamov E.V., Perminova I.V. Environmental Research, 2021, vol. 193, pp. 110312. DOI: 10.1016/j.envres.2020.110312.
Klöcking H.P. In Recent Developments in Toxicology: Trends, Methods and Problems: Proceedings of the European Societies of Toxicology Meeting Held in Leipzig. 1991, pp. 166–169. DOI: 10.1007/978-3-642-74936-0_33.
Zeck-Kapp G., Nauck M., Riede U.N., Block L., Freudenberg N., Seubert B. Verh. Dtsch. Ges. Path., 1991, vol. 75, pp. 504.
Neyts J., Snoeck R., Wutzler P., Cushman M., Klöcking R., Helbig B., Wang P., De Clercq E. Antiviral Chemistry and Chemotherapy, 1992, vol. 3, no. 4, pp. 215–222. DOI: 10.1177/095632029200300404.
Orlov A.A., Zherebker A., Eletskaya A.A., Chernikov V.S., Kozlovskaya L.I., Zhernov Y.V., Kostyukevich Y., Palyulin V.A., Nikolaev E.N., Osolodkin D.I., Perminova I.V. Scientific Reports, 2019, vol. 9, no. 1, pp. 12066. DOI: 10.1038/s41598-019-48000-y.
Mohimani H., Gurevich A., Shlemov A., Mikheenko A., Korobeynikov A., Cao L., Shcherbin E., Nothias L.F., Dorrestein P.C., Pevzner P.A. Nature communications, 2018, vol. 9, no. 1, pp. 4035. DOI: 10.1038/s41467-018-06082-8.
Cornell W.D., Cieplak P., Bayly C.I., Gould I.R., Merz K.M., Ferguson D.M., Spellmeyer D.C., Fox T., Caldwell J.W., Kollman P.A. Journal of the American Chemical Society, 1995, vol. 117, no. 19, pp. 5179–5197. DOI: 10.1021/ja00124a002.
Maier J.A., Martinez C., Kasavajhala K., Wickstrom L., Hauser K.E., Simmerling C. Journal of chemical theory and computation, 2015, vol. 11, no. 8, pp. 3696–3713. DOI: 10.1021/acs.jctc.5b00255
Pettersen E.F., Goddard T.D., Huang C.C., Couch G.S., Greenblatt D.M., Meng E.C., Ferrin T.E. Journal of computational chemistry, 2004, vol. 25, no. 13. Pp 1605–1612. DOI: 10.1002/jcc.20084.
Wang J., Wolf R.M., Caldwell J.W., Kollman P.A., Case D.A. Journal of computational chemistry, 2004, vol. 25, no. 9, pp. 1157–1174. DOI: 10.1002/jcc.20035.
Petrov D., Tunega D., Gerzabek M.H., Oostenbrink C. Environmental Science & Technology, 2017, vol. 51, no. 10, pp. 5414–5424. DOI: 10.1021/acs.est.7b00266.
Ai Y., Zhao C., Sun L., Wang X., Liang L. Science of the Total Environment, 2020, vol. 702, pp. 135072. DOI: 10.1016/j.scitotenv.2019.135072.
Bowman G.R., Geissler P.L. Proceedings of the National Academy of Sciences, 2012, vol. 109, no. 29, pp. 11681–11686. DOI: 10.1073/pnas.1209309109.
Avci F.G., Altinisik F.E., Vardar U.D., Ozkirimli O.E., Sariyar A.B. Journal of enzyme inhibition and medicinal chemistry, 2016, vol. 31, no. 3, pp. 33–40. DOI: 10.1016/j.jmb.2003.12.068.
Avci F.G., Altinisik F.E., Karacan I., Karagoz D.S., Ersahin S., Eren A., Sayar N.A., Ulu D.V., Ozkirimli E., Akbulut B.S. Journal of Molecular Graphics and Modelling, 2018, vol. 84, pp. 125–133. DOI: 10.1016/j.jmgm.2018.06.007.
Horn J.R., Shoichet B.K. Journal of molecular biology, 2004, vol. 336, no. 5, pp. 1283–1291. DOI: 10.1080/14756366.2016.1201813.
Copyright (c) 2024 Химия растительного сырья

Это произведение доступно по лицензии Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.

This work is licensed under a Creative Commons Attribution 4.0 International License.
Авторы, которые публикуются в данном журнале, соглашаются со следующими условиями:
1. Авторы сохраняют за собой авторские права на работу и передают журналу право первой публикации вместе с работой, одновременно лицензируя ее на условиях Creative Commons Attribution License, которая позволяет другим распространять данную работу с обязательным указанием авторства данной работы и ссылкой на оригинальную публикацию в этом журнале.
2. Авторы сохраняют право заключать отдельные, дополнительные контрактные соглашения на неэксклюзивное распространение версии работы, опубликованной этим журналом (например, разместить ее в университетском хранилище или опубликовать ее в книге), со ссылкой на оригинальную публикацию в этом журнале.
3. Авторам разрешается размещать их работу в сети Интернет (например, в университетском хранилище или на их персональном веб-сайте) до и во время процесса рассмотрения ее данным журналом, так как это может привести к продуктивному обсуждению, а также к большему количеству ссылок на данную опубликованную работу.











